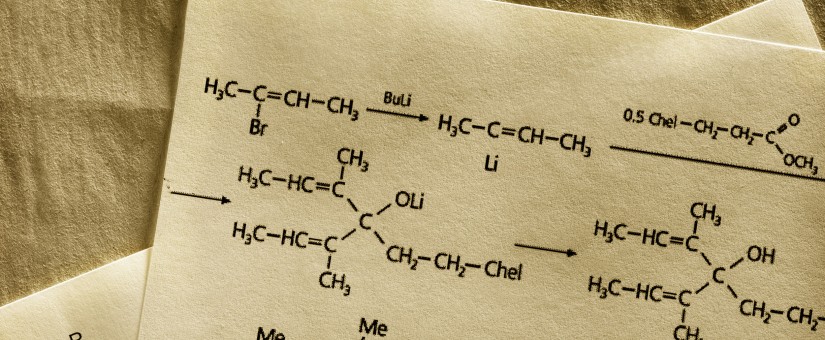
EMA opublikowała projekt wytycznej na temat wytwarzania końcowej postaci farmaceutycznej (Część I)
- 26 sierpnia 2015
- bulk, CTD, GDP, opis procesu, produkt gotowy, produkt pośredni, przechowywanie, przestrzeń projektowa, RTRT, strategia kontroli, transport, wytwarzanie,
9 lipca 2015 roku, EMA udostępniła do publicznych konsultacji na okres 6 miesięcy dokument pt. Draft guideline on manufacture of the finished dosage form. W tym miejscu należy nadmienić, że potrzeba aktualizacji i zmiany dokumentu CPMP/QWP/486/95 note for guidance on manufacture of the finished dosage form (aktualna wytyczna), została oryginalnie zaprezentowana w dokumencie pt. Concept