
Przegląd popularnych leków stosowanych w leczeniu nadciśnienia tętniczego – walsartanu – z powodu wykrycia zanieczyszczenia, N-nitrozodimetyloaminy (NDMA), substancji o prawdopodobnym działaniu rakotwórczym dla człowieka! (Część VIII)
- 29 maja 2019
- antagoniści receptora angiotensyny II, API, ARBs, artykuł 31, azylsartan, blokery receptora angiotensyny II, CEP, certyfikat zgodności, cukrzyca, DIPNA, dochodzenie, EDQM, EIPNA, EMA, eprosartan, Hetero Labs, irbesartan, kandesartan, KE, Komisja Europejska, kwas N-nitrozo-N-metyloamino masłowy, lek, limit, losartan, MA, MAH, N-nitrozodietyloamina, N-nitrozodiizopropyloamina, N-nitrozodimetyloamina, N-nitrozoetyloizopropyloamina, nadciśnienie tętnicze, NDEA, NDMA, nitrozoamina, NMBA, olmesartan, pierwotna, pioglitazon, podmiot odpowiedzialny, posiadacz, pozwolenie na dopuszczenie do obrotu, prawnie wiążące decyzje, proces wytwarzania, produkt leczniczy, przegląd, przyczyna, rak, sartany, specyficzna struktura pierścieniowa, substancja czynna, substancja o prawdopodobnym działaniu rakotwórczym dla człowieka, telmisartan, tetrazol, tymczasowy, walsartan, warunki pozwolenia na dopuszczenie do obrotu, wnioski naukowe, wytwarzanie, wytwórca, właściciel, zanieczyszczenie, zawieszenie, Zhejiang Huahai Pharmaceuticals, źródłowa,

INFORMACJE O WYDARZENIACH ON-LINE

Zachęcamy i serdecznie zapraszamy Wszystkich Państwa oraz Firmy
do uczestnictwa w wydarzeniach ON-LINE
Lhasa Limited jest organizacją not-for-profit dostarczającą firmom rozwiązania w zakresie oprogramowania, które wspomagają podejmowanie świadomych decyzji na temat bezpieczeństwa chemicznego, zmniejszając tym samym potrzebę przeprowadzania testów na zwierzętach, usprawniając długotrwały i kosztowny proces rozwoju nowych leków i zabezpieczając zdrowie ludzkie przed szkodliwym działaniem substancji chemicznych. Zastosowanie Derek Nexus i Sarah Nexus może być pomocne w zakresie spełnienia zgodności z wytycznymi ICH M7 a Mirabilis jest narzędziem analizy ryzyka, które pozwala użytkownikom obliczyć czy potencjalnie mutagenne zanieczyszczenie zostanie wypłukane na drodze syntezy. To z kolei zapewnia przemysłowi standardowe podejście, które jest uznawane przez regulatorów zgodnie z wytycznymi ICH M7. Więcej informacji można znaleźć na stronie internetowej: https://www.lhasalimited.org/.
WAŻNE! Aktualizacja [28/10/2020]
Po przeanalizowaniu wiedzy na temat obecności nitrozoamin w produktach leczniczych zdobytej od czasu rozpoznania sprawy sartanów i po uwzględnieniu danych ocenionych w przeglądzie dokonanym na mocy art. 5(3), w szczególności odnośnie przyczyn pierwotnych/źródłowych, gdy okazało się, że przyczyny pierwotne mogą być liczne, współistniejące na każdym etapie produkcji lub przechowywania produktu leczniczego i nie można ich zawsze scharakteryzować, CHMP uznał, że wynik przeglądu dokonanego dla sartanów powinien zostać ponownie rozpoznany w świetle wyniku przeglądu dokonanego na mocy art. 5(3).
Opinia CHMP na temt wpływu procedury z art. 5(3) dotyczącej nitrozoamin w produktach leczniczych stosowanych u ludzi na procedurę z art. 31 Dyrektywy 2001/83/WE przeprowadzoną dla produktów leczniczych-sartanów, zawierających pierścień tetrazolowy, ma zostać wydana w listopadzie 2020 r.
Aktualizacja [14/12/2020]
Komitet Europejskiej Agencji Leków (EMA) ds. produktów leczniczych stosowanych u ludzi (CHMP) ujednolicił rekomendacje w zakresie ograniczania zanieczyszczeń w postaci nitrozoamin w produktach leczniczych- sartanach, z ostatnimi zaleceniami, które wydał dla innych klas leków.
Główna zmiana dotyczy limitów dla nitrozoamin, które wcześniej miały zastosowanie do składników czynnych/aktywnych, ale teraz będą stosowane do produktów gotowych, np. tabletek. Te limity, oparte na standardach uzgodnionych na poziomie międzynarodowym (ICH M7(R1)), powinny zapewnić, że zwiększone ryzyko zachorowania na raka, wywołanego nitrozoaminami w jakichkolwiek sartanach, jest poniżej 1 w 100 000 dla osoby przyjmującej lek w terapii przez okres życia.
Zgodnie z wcześniejszymi zaleceniami, przedsiębiorstwa powinny dysponować właściwymi strategiami kontroli w celu zapobiegania lub ograniczenia obecności zanieczyszczeń w postaci nitrozoamin w możliwie największym stopniu oraz, gdzie to konieczne, udoskonalić swoje procesy wytwórcze. Firmy powinny również przeprowadzić analizę ryzyka w kierunku obecności nitrozoamin w ich lekach i przeprowadzić odpowiednie badania.
NEW! Aktualizacja [03/03/2021]
DECYZJA WYKONAWCZA KOMISJI z dnia 19.2.2021 r. zmieniająca decyzję Komisji C(2019) 2698 z dnia 2 kwietnia 2019 r. dotyczącą, na podstawie art. 31 dyrektywy 2001/83/WE Parlamentu Europejskiego i Rady, pozwoleń na dopuszczenie do obrotu produktów leczniczych stosowanych u ludzi, zawierających substancje czynne „kandesartan”, „irbesartan”, „losartan”, „olmesartan”, „walsartan” jest dostępna tutaj a Aneksy (Aneks I Wnioski naukowe i Aneks II Zmiany warunków pozwolenia (pozwoleń) na dopuszczenie do obrotu) są dostępne tutaj.
31 stycznia 2019 r. Europejska Agencja Leków (EMA) zaleciła, aby firmy wytwarzające sartany, leki regulujące ciśnienie krwi, które znane są również jako blokery receptora angiotensyny II (ARBs), dokonały przeglądu swoich procesów wytwarzania, tak aby nie tworzyły się w nich zanieczyszczenia w postaci nitrozoamin.
Raport ze wstępnego dochodzenia pierwotnej przyczyny obecności N-nitrozodimetyloaminy (NDMA), który firma Zhejiang Huahai Pharmaceutical z Chin dostarczyła na żądanie organu nadzorczego z Włoch (AIFA) wykazywał, że NDMA powstaje na etapie formowania pierścienia tetrazolowego w procesie wytwarzania substancji czynnej, walsartanu, produkowanego przez Zhejiang Huahai Pharmaceutical oraz, że poziom NDMA na jakim jest obecna, może zależeć od zastosowanych warunków reakcji.
W tym miejscu należy przypomnieć, że przegląd produktów leczniczych z walsartanem został uruchomiony przez Komisję Europejską (KE) 5 lipca 2018 r., na mocy art. 31 Dyrektywy 2001/83/WE. Po czym, 20 września 2018 r. przegląd został rozszerzony o leki zawierające kandesartan, irbesartan, losartan i olmesartan.
Antagoniści/blokery receptora angiotensyny II, które są przedmiotem procedury (grupa tetrazolowa w czerwonym kółku na przykładzie losartanu):
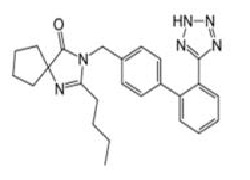
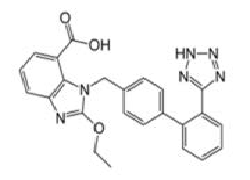
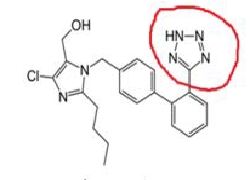
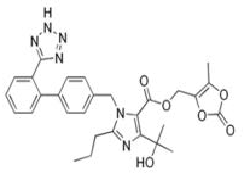
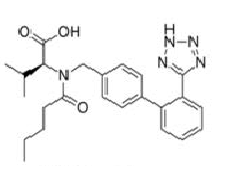
Wnioski naukowe dotyczące procedury zostały zaprezentowane w Aneksie I a Warunki pozwolenia/pozwoleń na dopuszczenie do obrotu w Aneksie II.
Należy jednak zauważyć, że istnieją inne ARBs dopuszczone do obrotu w UE, które nie zawierają grupy tetrazolowej i dlatego nie są przedmiotem tej procedury:
- Azylsartan,
- Eprosartan,
- Telmisartan.
Tymczasowe limity dla zanieczyszczeń NDMA, NDEA oraz NMBA, DIPNA i EIPNA zostały ustanowione zgodnie z aktualną wytyczną ICH M7(R1) i przedstawione w tabeli poniżej .
NDMA, NMBA
NDEA, DIPNA, EIPNA
Substancja czynna
Maksymalna dawka dobowa [mg]
Dopuszczalne spożycie [ng/dzień]
Limit [ppm]
Dopuszczalne spożycie [ng/dzień]
Limit [ppm]
Irbesartan
300
96,0
0,320
26,5
0,088
Kandesartan
32
96,0
3,000
26,5
0,820
Losartan
150
96,0
0,640
26,5
0,177
Olmesartan
40
96,0
2,400
26,5
0,663
Walsartan
320
96,0
0,300
26,5
0,082
NDMA – N-nitrozodimetyloamina
NDEA – N-nitrozodietyloamina
NMBA – kwas N-nitrozo-N-metyloamino masłowy
DIPNA – N-nitrozodiizopropyloamina
EIPNA – N-nitrozoetyloizopropyloamina
Zalecenia Europejskiej Agencji Leków (EMA) odnośnie NDMA i NDEA zostały przesłane do Komisji Europejskiej (KE), która wydaje prawnie wiążące decyzje.
Informowaliśmy już na naszej stronie o trwającym przeglądzie produktów leczniczych z walsartanem oraz innymi sartanami z powodu wykrycia zanieczyszczenia, N-nitrozodimetyloaminy (NDMA) a także o zawieszeniach certyfikatów zgodności (CEPs) przez EDQM we wpisach Część I, Część II, Część III, Część IV, Część V, Część VI oraz Część VII.

Dodatkowo, jako część ściślejszego monitorowania wytwarzania EMA oraz organy krajowe wnioskują również, przez ostrożność, aby firmy stosujące niektóre odczynniki do wytwarzania preparatów stosowanych w leczeniu cukrzycy zawierających pioglitazon, badały swoje produkty i sprawdzały swoje procesy w celu wykluczenia obecności zanieczyszczeń nitrozoaminami, a w szczególności N-nitrozodimetyloaminą (NDMA).
Wniosek jest pokłosiem wykrycia niskich poziomów NDMA w kilku seriach pioglitazonu wytwarzanego przez firmę Hetero Labs w Indiach, które mieściły się we wcześniej określonych limitach dla sartanów (patrz Aneks I powyżej) i uznaje się je za dopuszczalne bezpieczne.
Aby sprawdzić aktualny status CEP dla chlorowodorku pioglitazonu prosimy kliknąć tutaj.
Źródła: EMA, EDQM
Zaktualizowano: 2020-10-28
Powiązane wpisy:
Nitrozoaminy w produktach leczniczych stosowanych u ludzi – konsekwencje dla MAHs
Modele (Q)SAR – ważne narzędzie oceny ryzyka, wspomagające praktyczną implementację wytycznej ICH M7






