
Cofnięcie pozwoleń na dopuszczenie do obrotu dla leków zawierających chlorowodorek fenspirydu!
- 24 maja 2019
- bilans ryzyko-korzyść, CMDh, cofnięcie pozwoleń na dopuszczenie do obrotu, EMA, EU, fenspiride, fenspiryd, kaszel, MA, negatywny, objawowy, odcinek QT, odstęp QT, PRAC, produkt leczniczy, syrop, tabletki, torsades de pointes, UE, wydłużenie, zaburzenia rytmu serca, zawieszenie dostaw,
Komitet Europejskiej Agencji Leków (EMA) ds. bezpieczeństwa (PRAC) zalecił, że pozwolenia na dopuszczenie do obrotu produktów leczniczych zawierających fenspiryd zostaną cofnięte, a zatem produkty lecznicze nie mogą już być wprowadzane do obrotu w UE. To zalecenie jest następstwem przeglądu, który potwierdził, że te lekarstwa stosowane w leczeniu objawowym kaszlu mogą powodować zaburzenia rytmu serca.
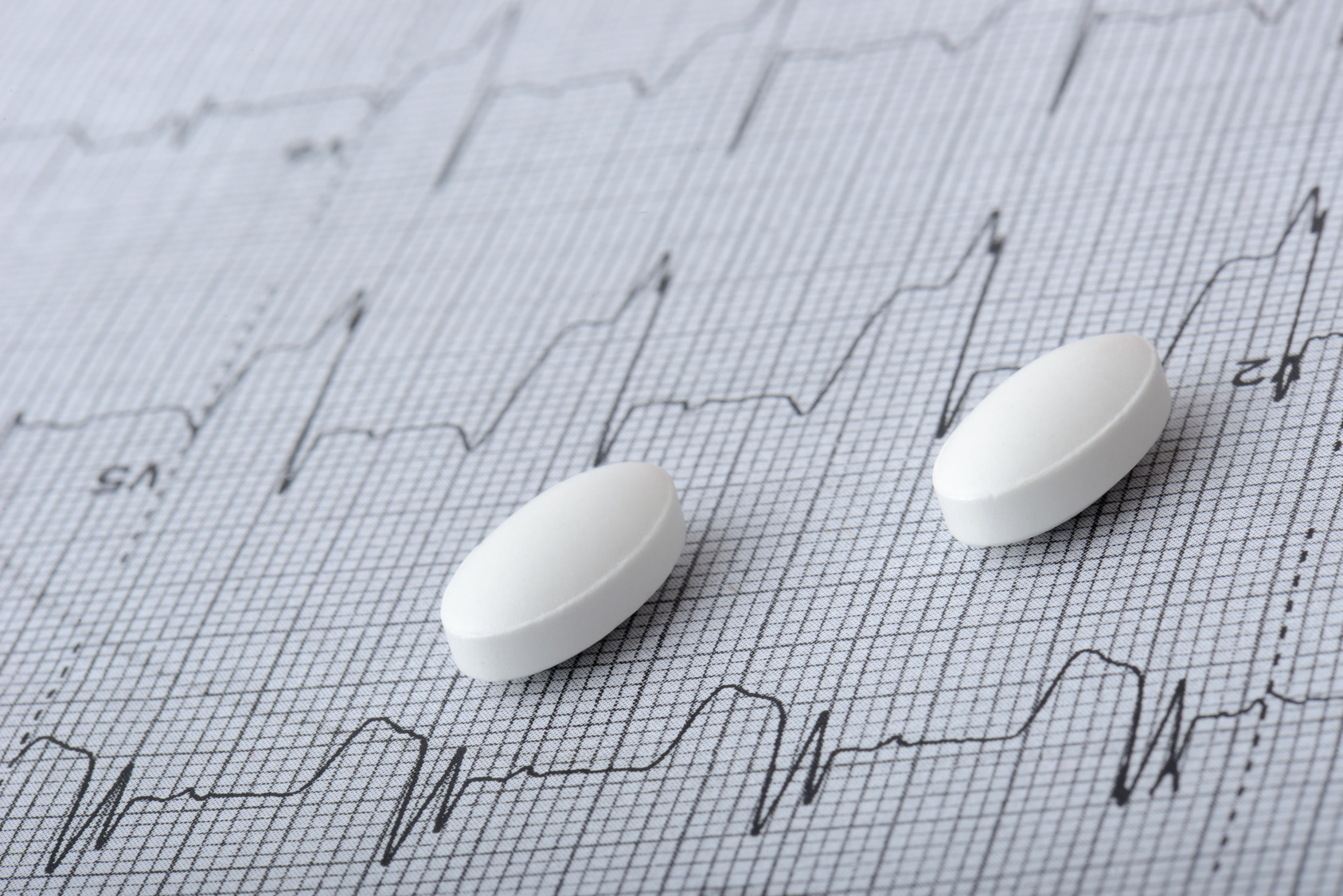
Komitet ds. bezpieczeństwa (PRAC) uwzględnił w swoim przeglądzie wszystkie dostępne dowody. Obejmuje to przypadki wydłużenia odcinka QT i torsades de pointes (nieprawidłowości dotyczących elektrycznej aktywności serca, która może prowadzić do zaburzeń rytmu serca) u pacjentów stosujących te preparaty lecznicze, wyniki badań laboratoryjnych, dane literaturowe oraz opinie zainteresowanych podmiotów.
Zaburzenia rytmu serca mogą być poważne i pojawić się nagle, do tego nie jest możliwe wcześniejsze wskazanie pacjentów, którzy mogą być narażeni na ryzyko wystąpienia takich zaburzeń po podaniu fenspirydu. Tymczasem, produkty lecznicze z fenspirydem stosuje się w objawowym leczeniu kaszlu.
Biorąc pod uwagę dozwolone stosowanie fenspirydu wyłącznie w leczeniu objawowym oraz powagę problemu w zakresie bezpieczeństwa, bilans ryzyko-korzyść dla tych produktów leczniczych jest negatywny dla obecnie dopuszczonych zastosowań. Stąd, Komitet ds. bezpieczeństwa (PRAC) uznał, że te preparaty nie powinny już być wprowadzane do obrotu.
Produkty lecznicze zawierające fenspiryd są dostępne w postaci syropu lub tabletek i stosowane u dorosłych oraz dzieci w wieku powyżej 2 lat w celu łagodzenia kaszlu wynikającego z chorób płuc. W UE produkty lecznicze z fenspirydem zostały dopuszczone do obrotu w procedurach narodowych w Bułgarii, Francji, na Łotwie, Litwie, w Polsce, Portugalii i Rumunii, dlatego rekomendacja Komitetu ds. bezpieczeństwa (PRAC) zostanie teraz przesłana do CMDh w celu podjęcia decyzji dotyczącej jej realizacji.
Lista produktów leczniczych, których dotyczy zalecenie PRAC jest dostępna tutaj.
Przegląd dotyczący fenspirydu rozpoczął się 14 lutego 2019 r. na wniosek Francji, na mocy art. 107i Dyrektywy 2001/83/WE. W tym czasie Komitet ds. Oceny Ryzyka w ramach Nadzoru nad Bezpieczeństwem Farmakoterapii (PRAC) zalecił zawieszenie dostaw produktów leczniczych zawierających fenspiryd jako środek zapobiegawczy, podczas gdy przegląd był już w toku.
Źródło: EMA




